JOHN PARKINSON
Los Institutos Nacionales de Salud (NIH) y Moderna anunciaron esta mañana que han comenzado un ensayo clínico de fase 3, llamado estudio COVE (Eficacia del coronavirus), para su vacuna en investigación para el coronavirus 2019 (COVID-19) .
La vacuna, conocida como ARNm-1273, fue desarrollada conjuntamente por NIH y Moderna. La prueba se llevará a cabo en sitios de EE. UU. Y se espera que inscriba aproximadamente 30000 adultos que no tienen el virus.
«Los resultados de las pruebas clínicas en la etapa inicial indican que la vacuna en investigación ARNm-1273 es segura e inmunogénica, lo que respalda el inicio de un ensayo clínico de fase 3», dijo el director del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) Anthony S. Fauci, MD. «Este ensayo científicamente riguroso, aleatorizado, controlado con placebo está diseñado para determinar si la vacuna puede prevenir COVID-19 y durante cuánto tiempo puede durar dicha protección».
En una amplia entrevista que dio el viernes pasado, Fauci habló sobre una serie de temas relacionados con COVID-19, incluidas las vacunas.
Moderna es una empresa de biotecnología con sede en Cambridge, Massachusetts, que lidera el ensayo como patrocinador regulador y proporciona la vacuna en investigación para el ensayo.
El ensayo está diseñado para evaluar la seguridad del ARNm-1273 y para determinar si la vacuna puede prevenir COVID-19 sintomático después de dos dosis. Como objetivos secundarios, el ensayo también tiene como objetivo estudiar si la vacuna puede prevenir COVID-19 grave o infección por SARS-CoV-2 confirmada por laboratorio con o sin síntomas de la enfermedad. El ensayo también busca responder si la vacuna puede prevenir la muerte causada por COVID-19 y si solo una dosis puede prevenir COVID-19 sintomático, entre otros objetivos.
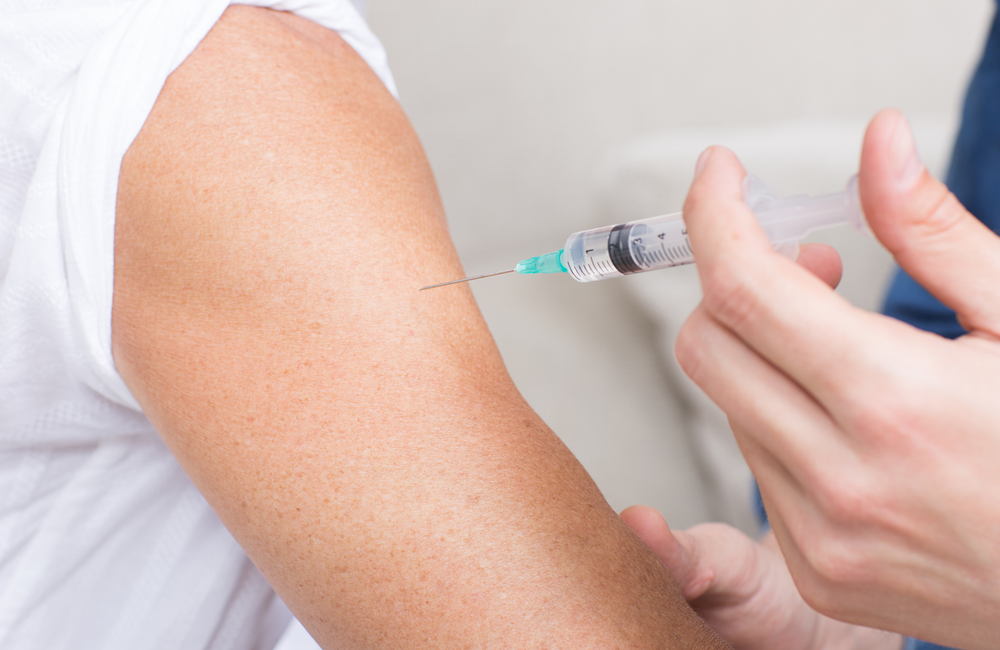
Los voluntarios de prueba recibirán dos inyecciones intramusculares con aproximadamente 28 días de diferencia. Los participantes serán asignados aleatoriamente 1: 1 para recibir dos inyecciones de 100 microgramos (mcg) de mRNA-1273 o dos inyecciones de un placebo de solución salina. El ensayo está cegado, por lo que los investigadores y los participantes no sabrán quién está asignado a qué grupo.
Ayer, Moderna anunció una modificación a su contrato con la Autoridad de Investigación y Desarrollo Avanzado Biomédico (BARDA) para un compromiso adicional de hasta $ 472 millones para apoyar su iniciativa de vacuna. Tanto BARDA de la Oficina del Subsecretario de Preparación y Respuesta del Departamento de Salud y Servicios Humanos de los Estados Unidos (HHS) y el NIAID están proporcionando fondos para el juicio.
El ensayo de eficacia de la vacuna es el primero que se implementa bajo la Operación Warp Speed, una colaboración de varias agencias dirigida por HHS que tiene como objetivo acelerar el desarrollo, la fabricación y la distribución de contramedidas médicas para COVID-19.
Los científicos del NIAID desarrollaron el inmunógeno estabilizado con espiga SARS-CoV-2 (S-2P). SARS-CoV-2 es el virus que causa COVID-19; La proteína espiga en su superficie facilita la entrada en una célula. El ARNm-1273 de Moderna utiliza la plataforma de administración de ARNm (ARN mensajero) para codificar un inmunógeno S-2P. La vacuna en investigación dirige a las células del cuerpo a expresar la proteína espiga para provocar una respuesta inmune amplia.
Un ensayo clínico de fase 1 encontró que la vacuna candidata es segura, generalmente bien tolerada y capaz de inducir anticuerpos con altos niveles de actividad neutralizadora de virus. Moderna inició la prueba de Fase 2 de la vacuna en mayo de 2020.
En: https://www.contagionlive.com/news/moderna-nih-begin-phase-3-trial-for-their-covid19-vaccine